Qual è l’impatto dell’antibiotico sul microbiota intestinale?
L’uso degli antibiotici, nonostante i numerosi vantaggi in campo infettivo, è spesso associato ad esisti negativi per la salute, in particolar modo se assunti per lunghi periodi oppure somministrati nelle prime fasi di sviluppo neonatale. La recente review The effect of antibiotics on the composition of the intestinal microbiota, analizza l’ampia mole di studi che correlano gli effetti negativi sul microbiota delle diverse classi di antibiotici. Conoscere i cambiamenti del consorzio microbico intestinale in base all’antibiotico utilizzato getta le basi per i possibili interventi probiotici e dietetici per ripristinarne l’eubiosi riducendo questo “danno collaterale”.
L’effetto degli antibiotici sul microbiota intestinale varia al variare della molecola utilizzata, probabilmente in base al suo spettro d’azione (ristretto vs ampio), alla via di somministrazione, alla farmacocinetica ed alla farmacodinamica:
- Amoxicillina, Cefalosporine e Macrolidi, dopo una singola terapia, apportano cambiamenti al microbiota intestinale per oltre 30 giorni
- Chinoloni e Clindamicina provocano disbiosi per quasi 2 anni.
In tutti i casi si assiste sempre ad una riduzione di bifidobatteri, che risultano i più sensibili agli antibiotici, e ad un aumento di Proteobacteria, phylum batterico Gram-negativo comprendente Klebsiella spp. ed Enterobacter.
Quali sono le principali conseguenze sul microbiota dopo l’antibiotico?
Anche se somministrato per un tempo limitato, l’antibiotico ha un impatto importante sul microbiota intestinale. Lo studio pubblicato su Plos-One Short-term effect of antibiotics on Human gut microbiota verifica che già dopo un singolo ciclo la biodiversità del microbiota intestinale si riduce del 25%.
Paradossalmente, dopo l’uso dell’antibiotico il numero di batteri intestinali aumenta leggermente ma a favore di specie Gram-negative, raggiungendo valori anche doppi rispetto a quelli di partenza.
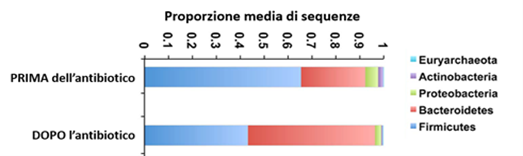
Questo rimodellamento microbico a favore dei batteri Gram-negativi suggerisce che la riduzione dei batteri sensibili agli antibiotici fornisce spazio a ceppi maggiormente resistenti che ne occupano la nicchia ecologica rimasta vuota. Tra tutti, i bifidobatteri ed i lattobacilli sono i primi a subire drastiche riduzioni, anche in seguito a una singola dose di antibiotico. Capire queste dinamiche potrebbe aiutare il clinico a cercare di rimodellare tempestivamente il microbiota intestinale con l’uso di batteri eubiotici al fine di ridurre l’infiammazione LPS-mediata dai Gram-negativi.
Quali sono le conseguenze sullo stato di salute della disbiosi intestinale?
La maggiore permeabilità intestinale e l’infiammazione mediata dai batteri Gram-negativi sono correlate a molte malattie: allergie, obesità, malattie metaboliche, infiammazioni croniche intestinali. In un recente lavoro pubblicato su Lancet nel 2020, Decreasing antibiotic use the gut microbiota and asthma incidence in children evidence from population based and prospective cohort studies, i ricercatori hanno analizzato oltre 4,7 milioni di bambini tra il 2000 e il 2014 dimostrando che ridurre l’uso di antibiotici porta ad una diminuzione significativa dell’incidenza di asma. Le evidenze sono ancora più evidenti se si analizzano le dosi di antibiotico somministrate sotto il primo anno di vita.
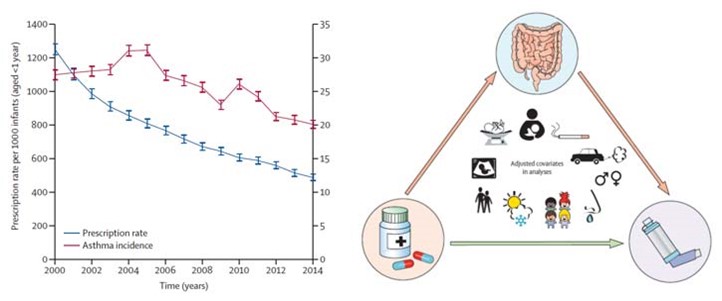
I ricercatori concludono che i bambini sottoposti ad antibioticoterapia hanno una biodiversità significativamente ridotta rispetto a quelli che non usano antibiotico, con un aumento dei batteri Gram-negativi.
La somministrazione di antibiotici risulta fondamentale per combattere determinate infezioni batteriche ma è ormai chiaro che, se da un lato si riducono i patogeni, dall’altro si crea una disbiosi a medio e lungo termine che può avere conseguenze sulla salute dell’individuo. Tra i batteri del consorzio microbico intestinale più suscettibili rientrano quelli eubiotici come i bifidobatteri. Conoscere le conseguenze disbiotiche dovute all’uso di antibiotici pone le basi per un possibile intervento mirato a ridurne questo effetto tramite la supplementazione di batteri probiotici e opportuni interventi dietetici

